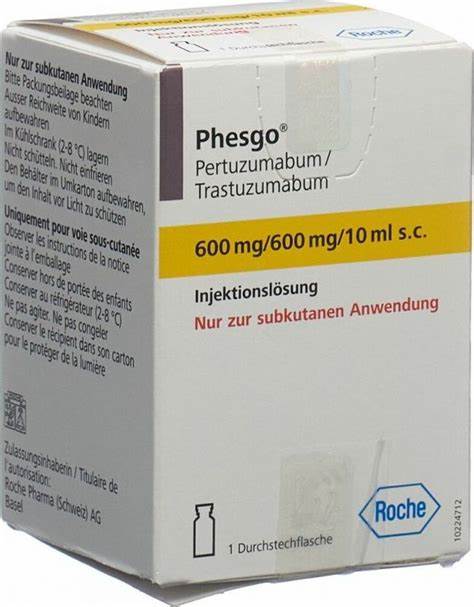
大约15%~20%的乳腺癌患者HER2过表达,CLEOPATRA、NeoSphere、APHINITY研究已经分别证实帕妥珠单抗+曲妥珠单抗可以显著提高HER2阳性晚期乳腺癌患者的总生存率、HER2阳性早期乳腺癌患者术前新辅助化疗的病理完全缓解率、HER2阳性早期乳腺癌高复发风险患者术后辅助化疗的无浸润病变生存率。不过,静脉注射帕妥珠单抗、曲妥珠单抗,每次分别需要30~60、30~90分钟。加入透明质酸酶的皮下注射制剂可将注射时间减少至几分钟。2020年6月29日,美国食品药品监督管理局根据2019年12月圣安东尼奥乳腺癌大会公布的FeDeriCa研究初步结果,批准了罗氏旗下基因泰克的固定剂量帕妥珠单抗+曲妥珠单抗+透明质酸酶三合一皮下注射制剂(商品名:PHESGO)用于HER2阳性乳腺癌早期术前新辅助和术后辅助治疗、晚期转移治疗,首次帕妥珠单抗1200毫克+曲妥珠单抗600毫克+透明质酸酶3万单位,皮下注射8分钟;随后每3周帕妥珠单抗600毫克+曲妥珠单抗600毫克+透明质酸酶2万单位,皮下注射5分钟。

2020年12月21日,英国《柳叶刀》肿瘤学分册在线发表美国基因泰克、北卡罗来纳医疗中心列文癌症研究所、韩国首尔大学医院癌症研究所、蔚山大学首尔峨山医院、巴西圣保罗佩罗拉·白灵顿医院、西班牙马德里自治大学公主医院、俄罗斯莫斯科市立临床肿瘤医院、波兰华沙肿瘤研究中心、意大利那不勒斯国家癌症研究所、法国巴黎居里学院、德国汉堡乳腺中心、奥芬巴赫萨纳医院、英国罗氏、瑞士罗氏的FeDeriCa研究术前新辅助治疗初步结果全文,对固定剂量帕妥珠单抗+曲妥珠单抗+透明质酸酶三合一皮下注射制剂与帕妥珠单抗+曲妥珠单抗静脉注射制剂用于HER2阳性早期乳腺癌术前新辅助化疗的药物代谢动力学、有效性和安全性进行了比较。
FeDeriCa (NCT03493854): A Phase III, Randomized, Multicenter, Open-Label, Two-Arm Study to Evaluate the Pharmacokinetics, Efficacy, and Safety of Subcutaneous Administration of the Fixed-Dose Combination of Pertuzumab and TRAStuzumab in Combination With Chemotherapy in Patients With HER2-Positive Early Breast Cancer
该国际多中心非盲随机对照非劣效三期临床研究于2018年6月14日~2018年12月24日从19个国家或地区106家医院入组年龄≥18岁、美国东部肿瘤学协作组体力状态评分0或1、左心室射血分数≥55%的II~IIIC期HER2阳性局部晚期或炎性乳腺癌可手术患者500例,按1∶1的比例通过语音或网络反馈系统随机分为两组:
-
静脉注射组252例:首次静脉注射帕妥珠单抗840毫克+曲妥珠单抗每公斤体重8毫克,随后每3周静脉注射帕妥珠单抗420毫克+曲妥珠单抗每公斤体重6毫克
-
皮下注射组248例:首次皮下注射15毫升帕妥珠单抗1200毫克+曲妥珠单抗600毫克,随后每3周皮下注射10毫升帕妥珠单抗600毫克+曲妥珠单抗600毫克
随机分组前,研究者从研究方案批准的两种标准方案(每2周多柔比星+环磷酰胺×4个周期→每周紫杉醇×12周,每3周多柔比星+环磷酰胺×4个周期→每3周多西他赛×4个周期)选择其一进行术前新辅助化疗,紫杉醇或多西他赛化疗期间给予HER2靶向治疗4个周期。术后,患者继续HER2靶向治疗14个周期,合计18个周期。
根据激素受体状态、临床分期和化疗方案对患者进行分层。主要终点为两组患者按研究方案用药并评定药物代谢动力学的第7个周期帕妥珠单抗血清谷浓度(即第8个周期用药前帕妥珠单抗浓度)非劣效性。非劣效性定义为几何平均比的90%置信区间下限≥0.8。对按研究方案用药(包括化疗或HER2靶向治疗)至少一次的全部患者进行安全性分析。入组、术前新辅助治疗和手术已经完成,术后辅助治疗和随访正在进行。
结果,皮下注射组与静脉注射组相比,帕妥珠单抗血清谷浓度的几何平均比为1.22(90%置信区间:1.14~1.31),达到主要终点。
静脉注射组与皮下注射组相比,病理完全缓解率为60%比60%,术前HER2靶向治疗+新辅助化疗期间发生率≥5%的3~4级不良事件:
-
中性粒细胞减少症:13%比14%
-
中性粒细胞计数减少:12%比11%
-
中性粒细胞减少症伴发热:6%比6%
-
腹泻:5%比7%
-
白细胞计数减少:7%比4%
-
治疗相关严重不良事件:10%比10%
两组各有1例致死不良事件(静脉注射组尿毒症1例,皮下注射组急性心肌梗死1例);死亡都与HER2靶向治疗无关。
因此,该研究结果表明,对于HER2阳性早期乳腺癌术前新辅助化疗患者,皮下注射固定剂量帕妥珠单抗+曲妥珠单抗与静脉注射帕妥珠单抗+曲妥珠单抗相比,第7个周期帕妥珠单抗血清谷浓度非劣效,病理学完全缓解率相似。两组安全性相似,并且与帕妥珠单抗、曲妥珠单抗和化疗的其他研究结果一致。正在随访长期结局,包括疗效和长期安全性。
对此,奥地利维也纳医科大学、德国埃森大学医院发表同期评论:FeDeriCa研究结果能否减轻乳腺癌治疗负担?